
Cell Discovery | 汤富酬团队与郝继辉团队合作揭示胰腺导管腺癌的表观遗传调控机制
胰腺癌是常见的消化道恶性肿瘤之一,因其极高的致死率被称为癌症之王,80%~90%的胰腺癌是胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)。由于胰腺是消化器官,且胰腺癌早期诊断非常困难、恶性程度高、手术切除率低、预后差,因此胰腺癌的临床取样相比于其他癌症更加困难,尤其是同一个病人很难取到肿瘤组织与正常组织的配对样品。以往基于全基因组分析的研究揭示了胰腺癌肿瘤组织的重要基因突变以及DNA甲基化的异常变化,说明胰腺癌的发生具有极其复杂的分子机制。近年来单细胞转录组研究也揭示了胰腺癌肿瘤组织的高度异质性,然而胰腺癌肿瘤细胞的表观基因组特征还没有被系统地研究过。
为了全面揭示胰腺导管腺癌肿瘤细胞的分子特征,北京未来基因诊断高精尖创新中心、北京大学生物医学前沿创新中心汤富酬课题组与天津医科大学肿瘤医院郝继辉课题组合作,对13例胰腺导管腺癌病人的肿瘤细胞进行了高精度单细胞多组学测序分析,系统解析了肿瘤细胞表观基因组(DNA甲基化组和染色质状态组)和转录组的关键特征及调控关系(图1)。相关研究成果于2022年2月15日以研究论文形式在线发表于 Cell Discovery 上,题为Integrated single-cell multiomics analysis reveals novel candidate markers for prognosis in human pancreatic ductal adenocarcinoma。


图1. 胰腺导管腺癌取样方法及研究思路示意图
该研究的主要发现有:
(1)胰腺导管腺癌原发肿瘤组织中存在较高比例的正常胰腺上皮细胞,为研究肿瘤细胞特征提供了精准对照。
在该研究中,研究人员对该实验室发展的单细胞多组学测序技术进行了优化,磁珠分离单个细胞的细胞核和细胞质之后,利用STRT-seq对细胞质部分进行转录组测序,用scCOOL-seq对细胞核部分进行测序,实现了同时检测单个细胞中的基因表达、基因组拷贝数变异、DNA甲基化以及染色质可及性状态。研究人员通过分析转录组数据,鉴定出胰腺上皮细胞,并根据拷贝数变异情况进一步区分肿瘤上皮细胞与正常上皮细胞。研究人员发现,在原发肿瘤组织中存在染色体倍性正常的胰腺上皮细胞,进一步分析表明它们的DNA甲基化和染色质状态与来自癌旁组织的正常上皮细胞非常相似(图2)。这些天然存在于肿瘤组织中的正常上皮细胞可以作为研究肿瘤细胞分子特征的精准对照,解决了胰腺癌配对对照样品难以获得的困难。此外,胰腺导管腺癌肿瘤细胞的DNA甲基化水平普遍低于正常上皮细胞,降低幅度为5%~20%,与结直肠癌(7%~36%)有所不同。
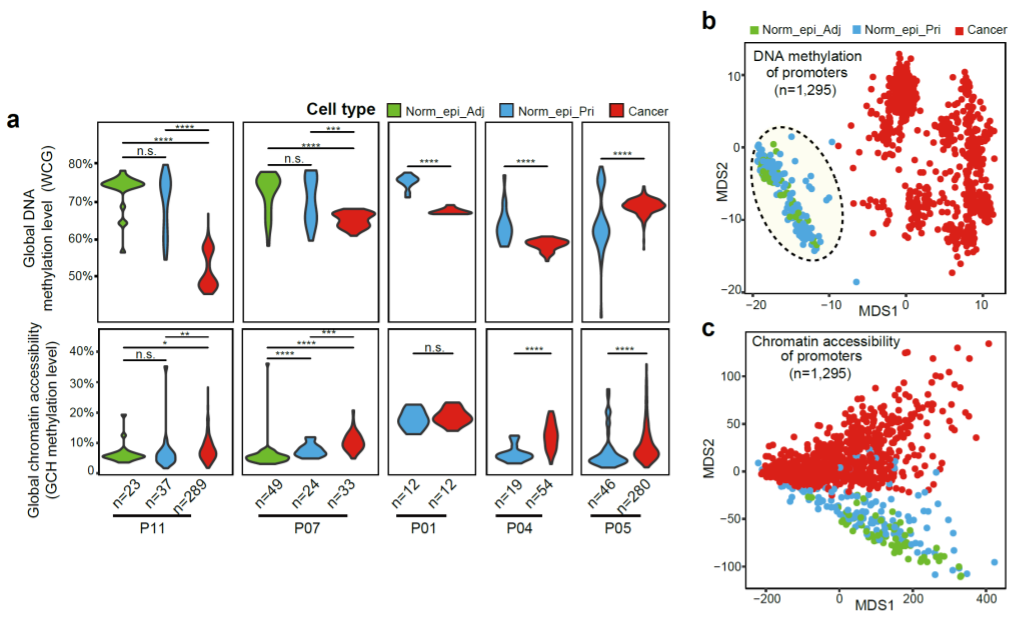
图2. 胰腺导管腺癌肿瘤细胞与正常上皮细胞的DNA甲基化和染色质状态特征
(2)胰腺导管腺癌肿瘤细胞中,数百个基因的启动子区域DNA甲基化发生强烈上调,相应的染色质从开放状态变为关闭状态,并在所有病人中呈现高度的一致性。这些结果提示使用DNA甲基化抑制剂重新激活这些在不同病人中普遍被DNA甲基化沉默的基因很可能有助于胰腺导管腺癌的治疗。
虽然胰腺导管腺癌肿瘤上皮细胞的整体DNA甲基化水平降低,但是基因启动子区域的差异甲基化分析结果显示,在肿瘤细胞中,基因启动子区域DNA甲基化上调的基因数目远远多于下调的基因数目(图3),说明在胰腺导管腺癌中有更多的基因由于启动子甲基化上调而被沉默表达。在不同肿瘤病人中,上调启动子甲基化的基因呈现高度的一致性,基因功能注释分析表明这些基因主要与神经系统功能、细胞命运和形态发生等生物学过程有关,提示这些基因在肿瘤发生发展中很可能发挥了重要作用。以上这些结果提示,如果使用DNA甲基化抑制剂重新激活这些被普遍沉默的基因,可能会有助于胰腺导管腺癌的治疗。

图3. 胰腺导管腺癌肿瘤细胞与正常上皮细胞的差异甲基化基因与功能注释
(3)胰腺导管腺癌肿瘤细胞中,基因启动子的DNA甲基化与相应基因的表达呈现增强的负相关关系,而基因本体(gene body)的DNA甲基化与相应基因的表达呈现增强的正相关关系,提示DNA甲基化在肿瘤发生过程中增强了对基因表达的调控作用。
研究人员通过在同一个单细胞中转录组与DNA甲基化组的相关性分析发现,相比于正常上皮细胞,肿瘤细胞的基因本体(gene body)的DNA甲基化与RNA表达量呈现更强的正相关关系(图4),并且,RNA表达量更低的基因,他们的基因本体去甲基化程度也更剧烈。除此之外,肿瘤细胞中基因启动子区域的DNA甲基化与RNA表达量呈现更强的负相关关系。以上结果说明DNA甲基化在肿瘤发生过程中增强了对基因表达的调控作用。

图4. 胰腺导管腺癌基因甲基化与相应基因表达量之间的相关性
(4)胰腺导管腺癌肿瘤细胞的全基因组范围的大规模DNA去甲基化强烈富集在异染色质区域,说明异染色质失稳是胰腺导管腺癌肿瘤发生过程的重要分子特征。
与正常上皮细胞相比,不同患者的胰腺导管腺癌肿瘤细胞经历了不同程度的全基因组规模的DNA去甲基化(P05病人除外)。研究人员发现,肿瘤细胞全基因组水平的去甲基化主要富集在异染色质区域,比如占基因组17%的重复元件Long interspersed element-1 (LINE-1)(图5)。然而,CpG岛、基因启动子和外显子区域在肿瘤细胞中的DNA甲基化水平却高于正常上皮细胞。研究人员还发现,肿瘤细胞的DNA去甲基化水平与LINE-1的密度呈正相关,但与H3K4me3、H3K27Ac和H3K36me3的密度呈负相关,这也表明胰腺导管腺癌肿瘤细胞的DNA去甲基化在异染色质区域(LINE-1富集区域)强烈富集,而不是常染色质区域(H3K4me3, H3K27Ac,或H3K36me3标记区域)。这些结果表明,胰腺导管腺癌的肿瘤发生可能涉及异染色质区域的表观遗传状态紊乱,包括普遍存在的DNA去甲基化过程,与之前的研究的结直肠癌结果类似。
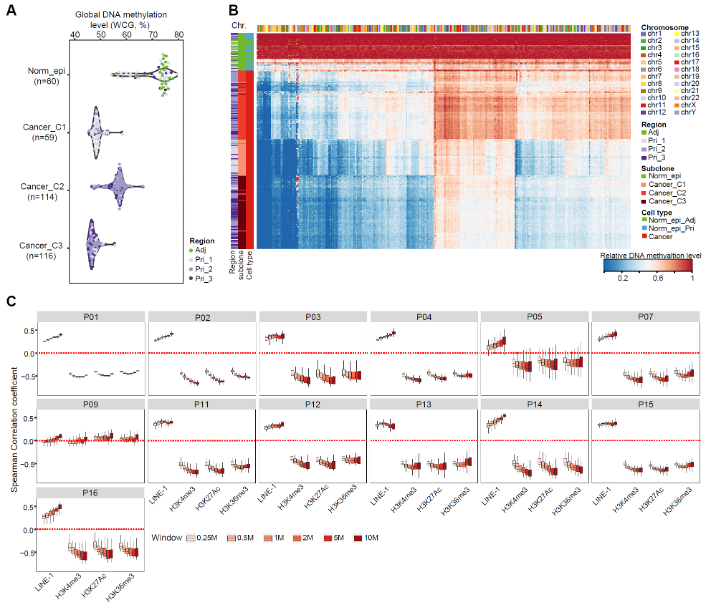
图5. 胰腺导管腺癌肿瘤细胞的基因组去甲基化富集在异染色质区域
(5)联合多组学分析揭示出以 FOSL2 (功能增强)、 ASCL1 (功能减弱)为代表的胰腺导管腺癌肿瘤发生过程中发挥重要作用的关键转录因子。
研究人员将染色质开放程度与基因表达水平进行了关联分析,发现启动子区域的染色质状态与基因表达水平呈现正相关关系(图6)。在肿瘤细胞和正常上皮细胞中分别鉴定出了64339和47622个染色质开放区域,其中约30%的区域是肿瘤细胞特异性的。通过对各自特异的开放区域转录因子结合序列富集分析,研究者鉴定出了胰腺导管腺癌肿瘤细胞特异性富集的转录因子家族,比如 FOSL2 基因,它在肿瘤细胞中呈现更高的表达水平和调控活性,并且其表达水平越高指示更差的预后,表明其调控活性增强在胰腺导管腺癌肿瘤发生过程中很可能发挥了重要作用。而与此相反,神经系统相关的转录因子,如 ASCL1 ,显著富集在正常上皮细胞中,在肿瘤细胞中呈现更低的表达水平和调控活性,并且其表达水平越低指示更差的预后,表明其调控活性降低在胰腺导管腺癌肿瘤发生过程中很可能发挥了重要作用。
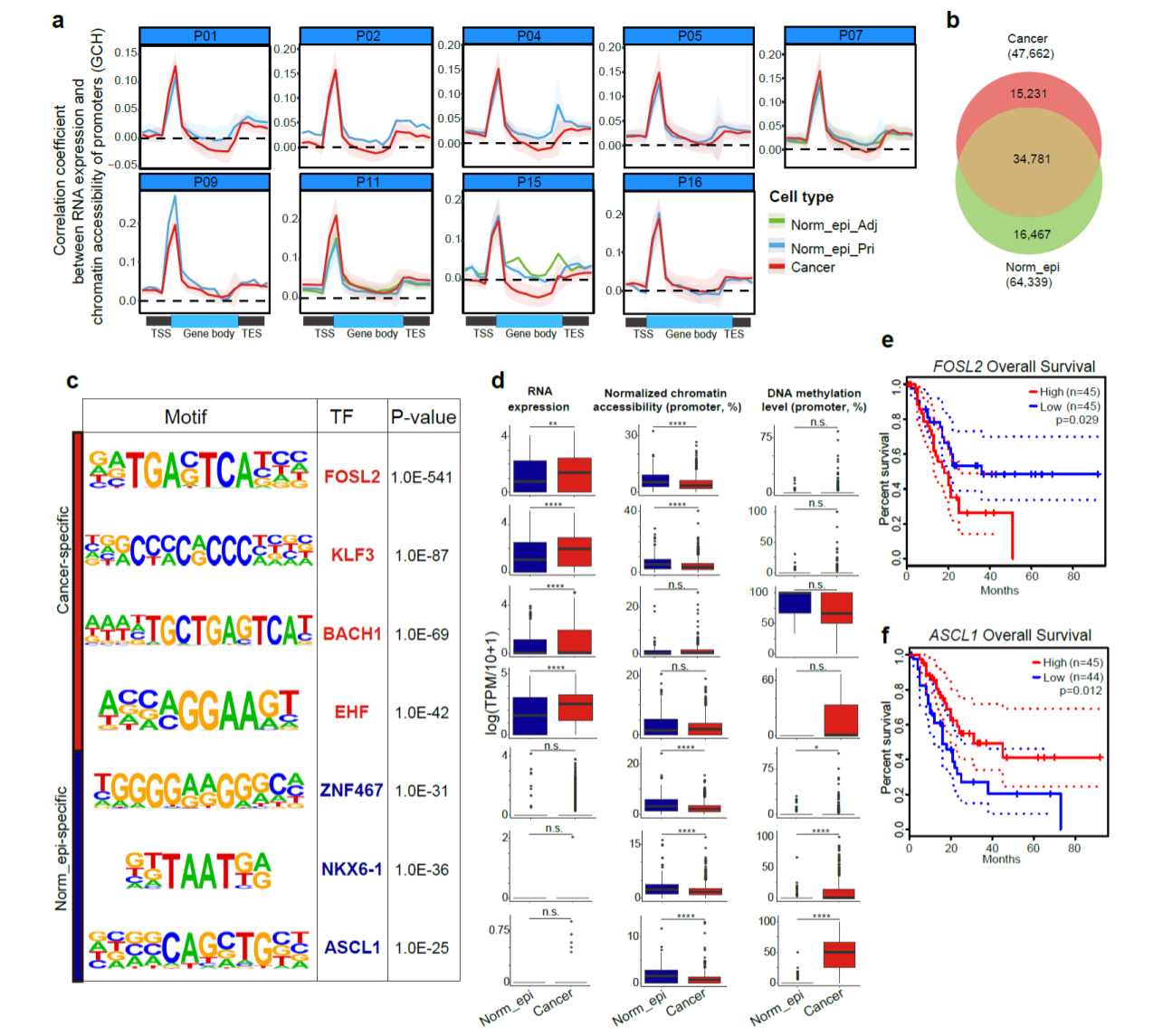
图6. 胰腺导管腺癌肿瘤细胞与正常上皮细胞特异的染色质开放区域以及转录因子结合序列富集分析
(6)通过DNA甲基化组与转录组联合分析筛选出以 ZNF667 和 ZNF667-AS1 为代表的胰腺导管腺癌预后候选标志物。
通过DNA甲基化与基因表达的联合分析,研究人员找到了77个候选的胰腺导管腺癌预后诊断分子标记的差异甲基化基因。其中, ZNF667 和 ZNF667-AS1 是在喉鳞癌以及非小细胞肺癌等癌症中被报道过的标记分子。研究者通过对98例PDAC病人肿瘤组织的ZNF667蛋白定量分析,发现高表达ZNF667蛋白的病人具有显著更长的生存时间。此外,研究人员发现在多种胰腺癌细胞系中分别过量表达 ZNF667 和 ZNF667-AS1 基因均能抑制肿瘤细胞增殖,但不影响肿瘤细胞凋亡,说明这两个基因主要是通过抑制细胞增殖来抑制胰腺导管腺癌的肿瘤发生。

图7. 生物信息学分析与功能验证揭示ZNF667和ZNF667-AS1为胰腺导管腺癌预后候选标志物
综上所述,该研究利用高精度的单细胞多组学测序分析,深度解析了胰腺导管腺癌肿瘤细胞不同组学维度的分子特征及其相互关系,并且通过不同病人肿瘤细胞共同变化的分子特征鉴定出一系列以 FOSL2、ASCL1、ZNF667 和 ZNF667-AS1 为代表的胰腺导管腺癌预后诊断的潜在分子标记,为胰腺导管腺癌的诊断和治疗提供了参考方案。
广州实验室研究员范小英,北京大学生命科学学院博士生陆平,天津医科大学肿瘤医院王宏伟博士,南京医科大学研究员卞舒惠和河北农业大学副教授吴兴龙为该论文的并列第一作者。北京未来基因诊断高精尖创新中心、北京大学生物医学前沿创新中心汤富酬教授与天津医科大学肿瘤医院郝继辉教授为该论文的共同通讯作者。该研究项目得到了国家自然科学基金委、北京市科技委和北京未来基因诊断高精尖创新中心的支持。