
Nature Cancer | 张泽民课题组与合作者揭示anti-PD-1免疫治疗在肺癌中的作用机制
2021年12月23日,北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)张泽民课题组联合301医院韩为东课题组在国际期刊Nature Cancer上发表了题为Temporal single-cell tracing reveals clonal revival and expansion of precursor exhausted T cells during anti-PD-1 therapy in lung cancer的研究论文,提出了克隆复兴(clonal revival)的概念并揭示了PD-1抗体治疗在肺癌中的作用机制。

以anti-PD-1为代表的免疫疗法显著地改善了癌症治疗的格局,但是免疫治疗只在一部分癌症患者中有作用。为了促进下一代免疫治疗的发展,首先需要清楚anti-PD-1治疗的作用机制。研究人员收集了anti-PD-1治疗前后的肺癌患者的肿瘤样本,利用单细胞测序系统地追踪了T细胞在治疗前后的动态变化,并分析了有响应患者和无响应患者之间的差异(图1)。
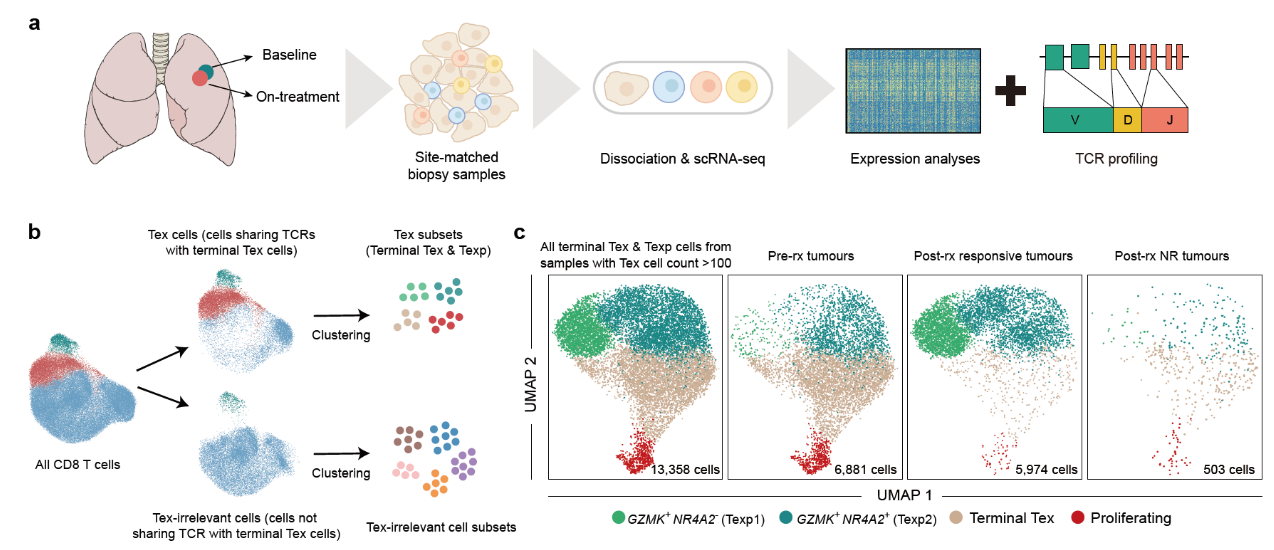
图1 课题研究方案及主要发现
肿瘤浸润T细胞既包含能够识别肿瘤抗原并杀伤癌细胞的肿瘤特异性T细胞,也包含专门识别非肿瘤抗原例如流感病毒的T细胞,而且在肿瘤中非肿瘤特异性T细胞占了很大一部分比例[1]。因此在分析过程中如何排除非肿瘤特异性T细胞的潜在影响,精准地研究肿瘤特异性T细胞的动态变化是一个挑战。之前的多个研究表明,由于肿瘤抗原的持续刺激,肿瘤中的肿瘤特异性CD8 T细胞克隆会同时高表达T细胞杀伤和“耗竭”相关基因,而非肿瘤特异性CD8 T细胞则不会表达“耗竭”相关基因[2-4]。因此在肿瘤中,耗竭CD8 T细胞可以当作肿瘤特异T细胞的一个替代[5]。
研究人员开发了一套新的分析思路(图1),首先通过聚类分析鉴定了耗竭CD8 T细胞类群,进而以耗竭CD8 T细胞克隆的TCR序列为基础,将所有的CD8 T细胞分为肿瘤特异性CD8 T细胞和非肿瘤特异性CD8 T细胞:根据上面提到的结论和假设,与耗竭CD8 T细胞有完全相同TCR序列的细胞为肿瘤特异性T细胞,剩下的为非肿瘤特异性T细胞。研究发现在有响应的肿瘤当中,治疗显著提高了耗竭信号低的肿瘤特异T细胞前体细胞的比例,表明了PD-1抗体可能阻断了肿瘤特异T细胞向耗竭状态的分化。相反,这一趋势在治疗前和治疗后无响应的肿瘤中并没有观察到。
有效治疗后肿瘤特异T细胞前体细胞的增加有三种可能:1. 耗竭T细胞的逆转;2. 肿瘤中之前存在的前体细胞的扩增;3. 来自肿瘤外例如外周血中的T细胞的补充。研究者通过相关分析排除了第一种可能,强调了后面两种模式的重要性。耗竭T细胞的逆转是领域内长期存在的一种假设,但是之前的小鼠研究表明耗竭T细胞的表观修饰和特征是稳定的,很难改变[6]。研究者对人类肿瘤的分析进一步支持了这一观点。
此外,之前斯坦福大学Howard Chang研究组提出了克隆替代(clonal replacement)的概念,认为治疗后肿瘤中的肿瘤特异T细胞的克隆型都是新出现的[7]。而该研究发现,在肺癌治疗的过程中,新的克隆和之前存在的克隆都会被招募到肿瘤中进而发挥功能(图2)。针对这一现象,研究人员提出了克隆复兴(clonal revival)的概念,拓展了clonal replacement的模式。该研究的科学发现揭示了anti-PD-1疗法在肺癌中的作用机制,为开发新的临床检测与治疗手段提供了新的思路。
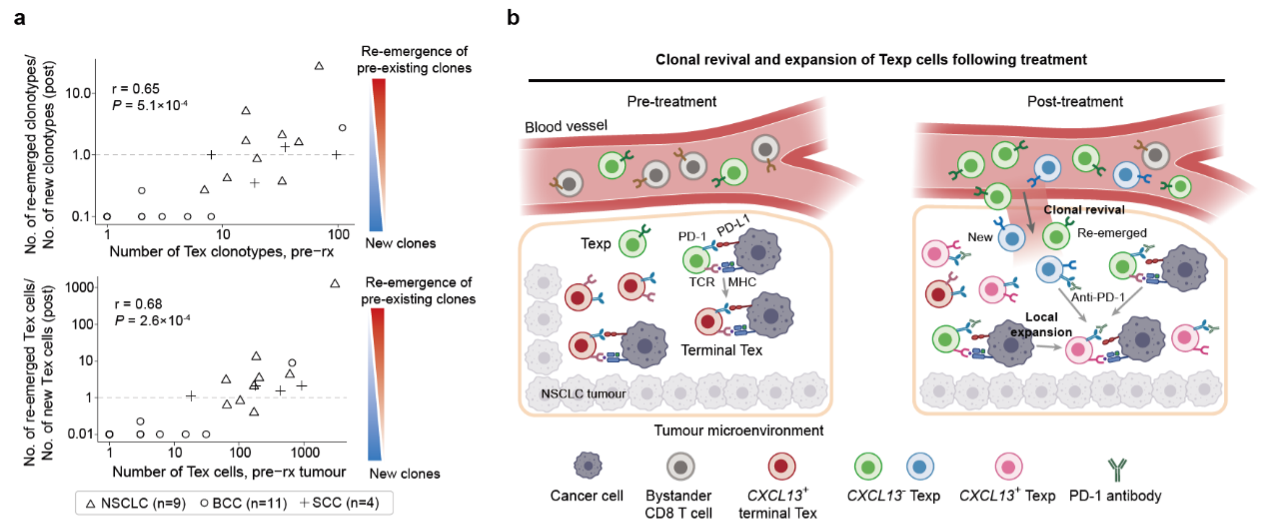
图2 克隆复兴 (clonal revival)
北大BIOPIC/生命科学学院博士生刘宝琳,百奥智汇胡学达博士以及301医院丰恺超博士为该论文的并列第一作者。北京大学BIOPIC/生命科学学院张泽民教授和301医院韩为东教授为该论文的共同通讯作者。该研究得到北京市科委、国家自然科学基金、国家重点研发计划、ICG、和勃林格殷格翰(Boehringer Ingelheim GmbH)公司的支持和资助。
论文链接: https://www.nature.com/articles/s43018-021-00292-8
参考文献:
[1] Simoni et al., Bystander CD8+ T cells are abundant and phenotypically distinct in human tumour infiltrates, Nature (2018).
[2] Caushi et al., Transcriptional programs of neoantigen-specific TIL in anti-PD-1-treated lung cancers, Nature (2021).
[3] Oliveira et al., Phenotype, specificity and avidity of antitumour CD8+ T cells in melanoma, Nature (2021).
[4] Ahmadzadeh et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired. Blood (2009).
[5] van der Leun et al., CD8 + T cell states in human cancer: insights from single-cell analysis, Nat Rev Cancer (2020).
[6] Pauken et al., Epigenetic stability of exhausted T cells limits durability of reinvigoration by PD-1 blockade, Science (2016).
[7] Yost et al., Clonal replacement of tumor-specific T cells following PD-1 blockade, Nat. Med. (2019).