
Science | 张泽民课题组与合作者发表泛癌症T细胞单细胞图谱
2021年12月17日,北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)张泽民课题组联合北京大学肿瘤医院季加孚、步召德课题组以及北京大学第三医院,在国际期刊Science上发表了题为Pan-Cancer Single Cell Landscape of Tumor-Infiltrating T Cells的研究论文。结合单细胞基因表达谱和 T细胞受体序列,研究者系统地刻画了肿瘤浸润性T细胞的异质性和动态性,并系统地比较了癌症类型之间的异同。

T细胞是最关键的抗肿瘤免疫细胞,其中毒性T细胞是杀伤癌细胞的最主要细胞类群。肿瘤浸润T细胞中含有应答肿瘤抗原的T细胞。然而伴随着肿瘤发生发展过程,这些T细胞往往分化为功能失调状态,即T细胞耗竭。调节肿瘤浸润T细胞的治疗方法已经取得了显著的临床效果,但在不同癌症类型之间差异很大。越来越多的证据表明不同癌种的肿瘤微环境对塑造T细胞的组成和状态发挥着重要作用。单细胞转录组测序 (scRNA-seq) 已成功应用于多种癌症的肿瘤微环境的精细解析。例如,利用单细胞测序和生物信息技术,张泽民课题组及合作者之前曾对三个癌种,即肝癌、非小细胞肺癌和结直肠癌完成了单细胞水平的T细胞研究。但迄今为止仍然缺少对不同癌症类型的T细胞在单细胞水平进行系统比较分析。
为了更好地了解肿瘤浸润T细胞的全貌,揭示癌种间的共性和特殊性,该研究新产生了更多癌种的T细胞数据,包括骨髓瘤、淋巴瘤、肾癌、卵巢癌、子宫内膜癌、食道癌、甲状腺癌、乳腺癌、胃癌和胰腺癌,并广泛收集领域内已发表的类似数据。该研究通过创新生物信息方法,校正混杂因素和批次效应后,有效整合了不同实验平台和实验室来源的数据,从而构建了系统的单细胞水平的泛癌症T细胞图谱(图1)。图谱最终涵盖了来自21种癌症类型的316名患者的397,810高质量T细胞数据。
该研究一共识别出17个CD8+ T细胞类群和24个CD4+ T细胞类群。癌、癌旁组织和外周血的T细胞组成具有明显的差异。特别是,癌组织中出现了特有的耗竭CD8+ T细胞,而TNFRSF9+ Treg也在癌组织中高度富集。这些结果表明,肿瘤微环境明显地重塑了T细胞的状态。
该研究揭示了 CD4+和CD8+ T细胞亚群的异质性、分化路径以及转录调控。对于 CD8+ T 细胞,研究者揭示了T细胞耗竭的两种常见主要途径,即分别通过效应记忆T细胞和组织驻留T细胞这两种未耗竭状态。此外,KIR+ 类NK态T 细胞、TC17细胞或CD8+ Treg细胞均有可能转化为耗竭T细胞,但这些转化只在少数癌种中观察到。研究者进一步分析了T细胞耗竭相关的转录因子。TOX,PRDM1等已被报道的转录因子在大多数癌种的耗竭T细胞里高表达,但也有一些转录因子的表达呈现一定的癌种偏向性,如SOX4和FOXP3等。对于 CD4+ T 细胞,IFNG+ TFH/TH1 和TNFRSF9+ Treg是两群主要的潜在肿瘤响应T细胞。该研究推断IFNG+ TFH/TH1 细胞可能由经典的IL21+TFH分化而来。TNFRSF9+ Treg主要由其他Treg转化而来,但在少数癌种里TNFRSF9+ Treg可能从一些非Treg 细胞转化而来,如TH17和TFH。
该研究还探索了多种因素和肿瘤浸润T细胞组成的关系。肿瘤的突变总量以及具体的基因突变都能够影响肿瘤浸润T细胞。例如,肿瘤突变负荷与IFNG+ TFH/TH1 细胞的比例显著正相关,而肿瘤的FAT1体细胞突变与TNFRSF9+ Treg细胞的比例也显著正相关。此外,研究者发现肿瘤浸润T细胞的组成在不同癌种间也有显著差异。基于此,研究者提出了根据肿瘤浸润T细胞的组成对患者进行免疫分型。研究者发现可以将癌症患者分为终末耗竭 CD8+ T 细胞占比高与组织驻留记忆 CD8+ T 细胞占比高的两个组群,并且后者总体上比前者有更好的生存预后。
该单细胞水平的泛癌种T细胞研究在多方面加深了人们对肿瘤浸润T细胞的认识,也将进一步促进新的癌症免疫治疗方法开发。
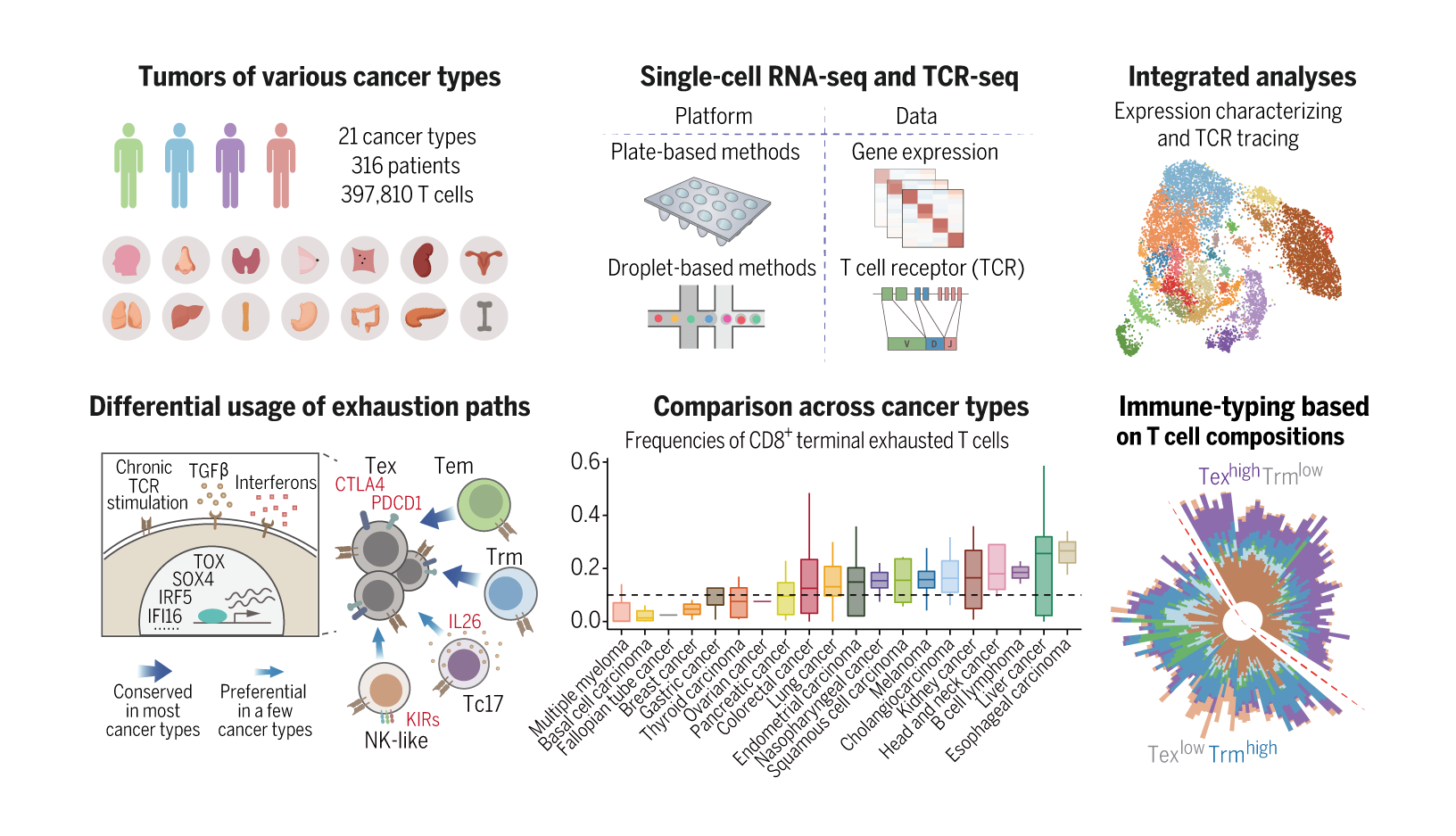
T细胞单细胞图谱的研究框架和主要发现
北京大学前沿交叉学科研究院博士毕业生郑良涛、生命科学学院博士生秦世尚、前沿交叉学科研究院博士后司雯为该论文的并列第一作者,北京大学BIOPIC和生命科学学院张泽民教授、北京大学肿瘤医院季加孚教授和步召德教授、百奥智汇胡学达博士为该论文的共同通讯作者。该课题得到了国家自然科学基金、北京市生命科学前沿创新培育项目和北京未来基因诊断高精尖创新中心的资助,以及北大高通量测序平台的协助与支持。