
Cell | 张泽民课题组与合作者揭示结直肠癌靶向髓系细胞的免疫治疗机理
2020年4月16日,北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)、北大-清华生命科学联合中心张泽民课题组联合美国安进(Amgen)公司Jackson G. Egen、Xin Yu团队,和北京大学人民医院申占龙课题组在Cell杂志上以Article形式在线发表题为"Single-Cell Analyses Inform Mechanisms of Myeloid-Targeted Therapies in Colon Cancer"的文章。该研究利用单细胞转录组测序技术对结直肠癌患者的肿瘤微环境,特别是浸润髓系细胞类群首次进行了系统性的刻画,同时利用小鼠模型,对anti-CSF1R抑制剂和anti-CD40激动剂两种靶向髓系细胞的免疫治疗策略潜在的作用机理给出了解释。
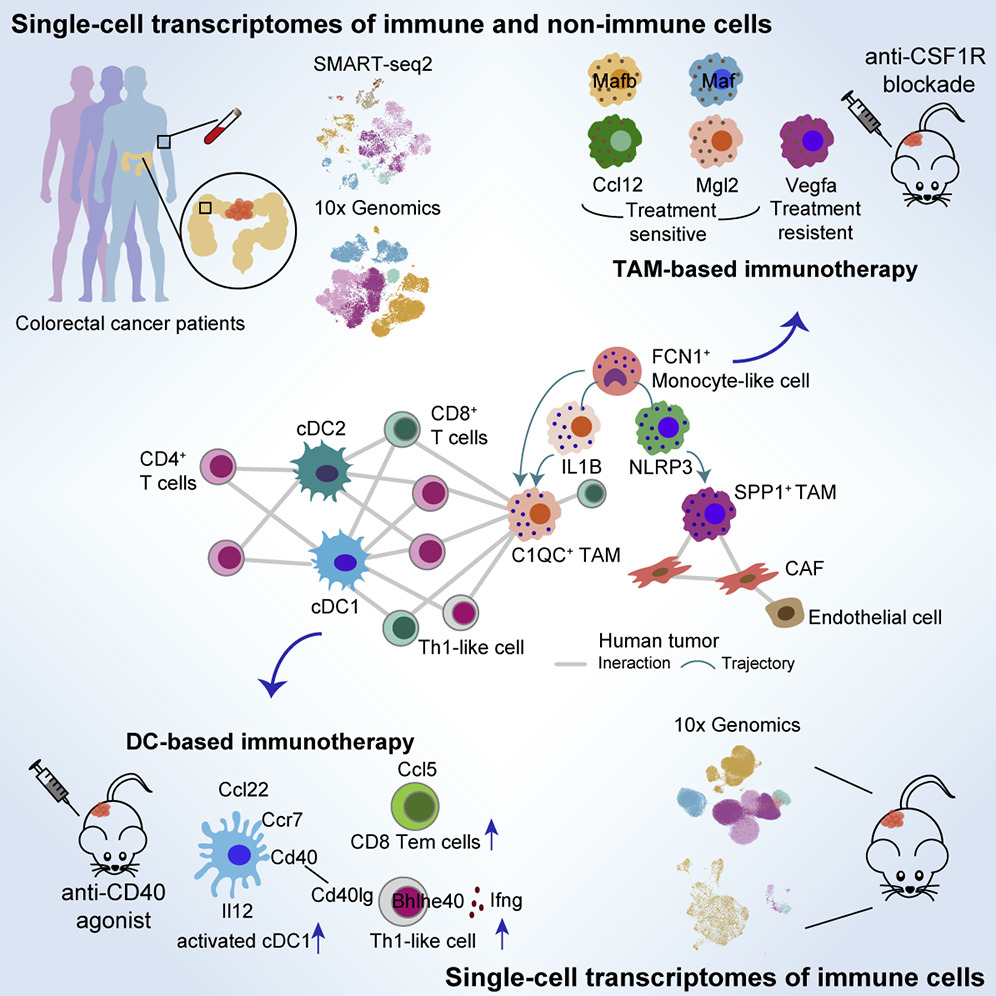
图 课题总体设计与免疫治疗作用机制
肿瘤浸润髓系免疫细胞在肿瘤微环境中既是最主要的抗原提呈细胞,也是肿瘤发生和生长的关键调节因子,在病人对肿瘤免疫疗法的响应过程发挥着极为重要的作用。多项靶向髓系免疫细胞如肿瘤相关巨噬细胞(TAM)和树突状细胞(DC)的治疗策略已进入临床前试验。然而,由于我们对肿瘤微环境复杂性的不完全了解,极大地限制了我们对靶向髓系细胞治疗的具体作用机制及有效性的认知和临床应用。
在该项研究中,研究人员首先使用10x及Smart-seq2两种技术对从结直肠癌患者中收集的免疫和非免疫细胞进行单细胞转录组测序,并从中发现肿瘤相关巨噬细胞可以被分为SPP1 +TAM和C1QC + TAM两个具有不同发育来源、不同细胞功能和不同细胞间相互作用关系的细胞类群。其中,C1QC + TAM可能通过IL1B +的巨噬细胞发育而来,主要与多种T细胞亚群发生相互作用,发挥细胞吞噬和抗原呈递的功能;而SPP1 + TAM则可能由NLRP3 +的组织驻留巨噬细胞发育而来,主要与肿瘤相关成纤维细胞(CAF)发生相互作用,发挥促血管生成及促进肿瘤转移的功能。值得注意的是,结合肠炎病人及健康受试者的单细胞转录组数据,研究人员首次发现,SPP1 + TAM特异性地富集在结直肠癌病人癌组织中,提示在结直肠癌肿瘤发生发展中的重要作用。
基于以上针对结直肠癌病人肿瘤微环境的解析,研究人员接着利用小鼠肿瘤模型来研究靶向不同髓系细胞类群对抗肿瘤免疫反应造成的影响。研究者分别在MC38和Renca两种小鼠模型中进行了anti-CD40与anti-CSF1R的治疗,并获得小鼠肿瘤浸润免疫细胞单细胞转录组图谱。与以上结直肠癌病人相比,DC和T细胞亚群在人和小鼠肿瘤中均有较高的一致性。而尽管巨噬细胞在人鼠间的异质性高于其他免疫细胞类群,但在小鼠肿瘤中也存在着SPP1 + TAM和C1QC + TAM的相似巨噬细胞亚群。
通过对治疗前后各细胞亚群比例及转录组的变化进行分析,研究人员发现anti-CSF1R阻断型抗体会影响处在细胞周期中的巨噬细胞的增殖,并会特异性地删除掉一定比例的具有C1QC +TAM特征的巨噬细胞,却不会对具有SPP1 + TAM特征的巨噬细胞起到作用,提示anti-CSF1R治疗后保留了在肿瘤中具有促进肿瘤血管生成功能的巨噬细胞。
Anti-CD40激动剂治疗可以使MC38小鼠的肿瘤体积缩小,且在与PD1阻断剂联合使用后还可以进一步抑制肿瘤的生长。本研究发现,使用anti-CD40激动剂对MC38小鼠进行治疗后的第2天,激活态的Ccl22 + cDC1细胞即迅速做出响应,细胞比例显著增加。同时,在人鼠间保守的Bhlhe40 + Th1细胞比例也显著上升。使用研究组此前开发的针对T细胞及其克隆性的分析方法STARTRAC,研究人员发现anti-CD40激动剂治疗后,Bhlhe40 + Th1细胞的克隆增生显著增强。相比CD4+ T细胞,CD8+ T细胞的响应速度则较慢,仅在治疗后的第10天,可以观察到Ccl5 + Tem细胞和Cxcr6 + Trm细胞比例的显著增加,值得注意的是,Tem细胞在淋巴结和肿瘤间的迁移能力,及该群细胞与Trm细胞间的转换能力也在治疗后有着显著的提升,提示此群Tem细胞可能与stem-like T细胞相似,具有补充池(Pool)的功能。
该工作对此前团队针对结直肠癌肿瘤浸润T细胞的研究有很好的延续性和前瞻性。此前研究中发现MSI结直肠癌病人中会富集一群BHLHE40 + Th1-like细胞,认为可能是该类型患者免疫治疗响应更好的原因之一。而对于MSS病人的治疗响应仍缺乏认识。在此项结合人鼠单细胞转录组的工作中,团队首次发现靶向DC的治疗策略ani-CD40可以显著地提高此类细胞的水平,为MSS病人的临床治疗策略提供一定的指导。而对SPP1 + TAM细胞的发现和功能分析,以及对靶向TAM的药物机制的研究,将大大有助于后续靶点的挖掘及新的治疗策略的开发。
北大-清华生命科学联合中心CLS博士后张雷博士,北京大学生命科学学院博士生李子逸、Amgen公司炎症与肿瘤部Katarzyna M. Skrzypczynska博士为该论文的并列第一作者,北京大学BIOPIC,生命科学学院, ICG和CLS张泽民教授、Amgen科学家Jackson G. Egen博士和Xin Yu博士以及北京大学人民医院胃肠外科申占龙教授为该论文的共同通讯作者。Amgen炎症与肿瘤免疫部负责人欧阳文军博士对此研究提供了宝贵建议。该研究得到国家重点研发计划,国家自然科学基金,ICG和Amgen的支持和资助。合作团队声明本文所述实验,均经过伦理委员会的批准和通过,并严格按照批件所述的要求和流程实施。