
Nature丨张泽民课题组与合作团队共同报道肿瘤转录组变异领域的重大进展
2020年2月5日,北京大学张泽民教授团队与Alvis Brazma,Angela Brooks,Gunnar Rätsch等研究群体合作在《Nature》杂志发表了题为“Genomic basis for RNA alterations in cancer”的研究论文,报道了肿瘤转录组变异领域的重大进展。
在肿瘤转录组中会发生各种不同形式的变异,例如基因的异常高表达(overexpression)、剪接形式改变(altered splicing)、形成融合基因(gene fusions)等,这些肿瘤转录组变异的产生机制可能与基因组层面的突变如单核苷酸突变、插入/缺失、拷贝数变异、结构变异等有关,但尚未被系统研究。在本课题中,研究人员整合分析了PCAWG(Pan-Cancer Analysis of Whole Genomes)联盟中27个癌种共1,188个肿瘤的转录组及全基因组测序数据,系统地描绘了迄今为止最为全面的肿瘤转录组变异图谱,并揭示了转录组变异的成因及其与基因组变异的关联。研究人员发现肿瘤中的表达量变异和等位基因表达不平衡在很大程度上与体细胞拷贝数变异和单核苷酸变异有关。此外,单核苷酸突变还可能导致基因内含子区域中新外显子的形成,从而发生新的可变剪接事件。大部分融合基因的形成则源于癌症基因组中的结构变异。转录组的变异特征(signatures)在各癌种中有所区别,且与DNA的突变特征有关。
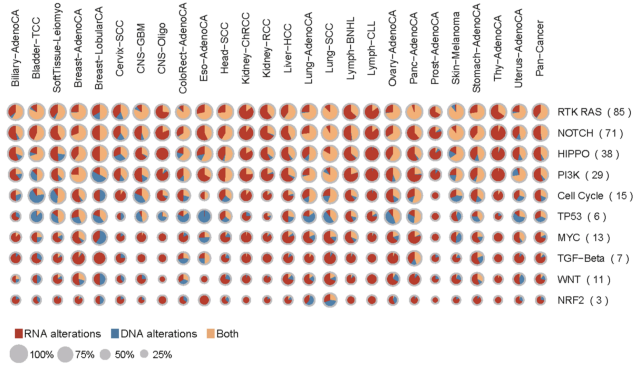
图1.DNA变异和RNA变异影响癌症通路
张泽民团队的研究人员深入分析了肿瘤中的等位基因表达不平衡现象。他们发现肿瘤组织相比于相应的健康组织具有更高的等位基因表达不平衡比例。利用逻辑回归模型,他们鉴定出等位基因表达不平衡的决定因素:除体细胞拷贝数变异外,单核苷酸突变,包括种系表达数量性状基因座(eQTL)变异和体细胞突变,也对等位基因表达不平衡具有重要影响。相同突变热点在不同癌种中具有不同的等位基因不平衡特征。此外,体细胞突变引起的等位基因表达不平衡事件在已知的癌症驱动基因中富集。据此,研究人员预测错配修复相关的基因EXO1可能是新的癌症驱动基因。
张泽民团队的研究人员总结了融合基因的基因组成因并形成了一致的分类系统。相当一部分融合基因需要由一系列结构变异事件共同造成。其中最为特别的一类事件需要由另一个不相关的染色体片段作为桥梁将不同的染色体连接起来,从而形成融合基因,研究人员将此类融合基因命名为“桥式融合基因“。在功能上,研究人员发现有一些“滥交”基因(promiscuous genes)经常性地和其它基因发生融合。此类基因显著地富集在癌症驱动基因中,提示其在肿瘤微环境中遭到了强选择,扮演一定的功能角色。
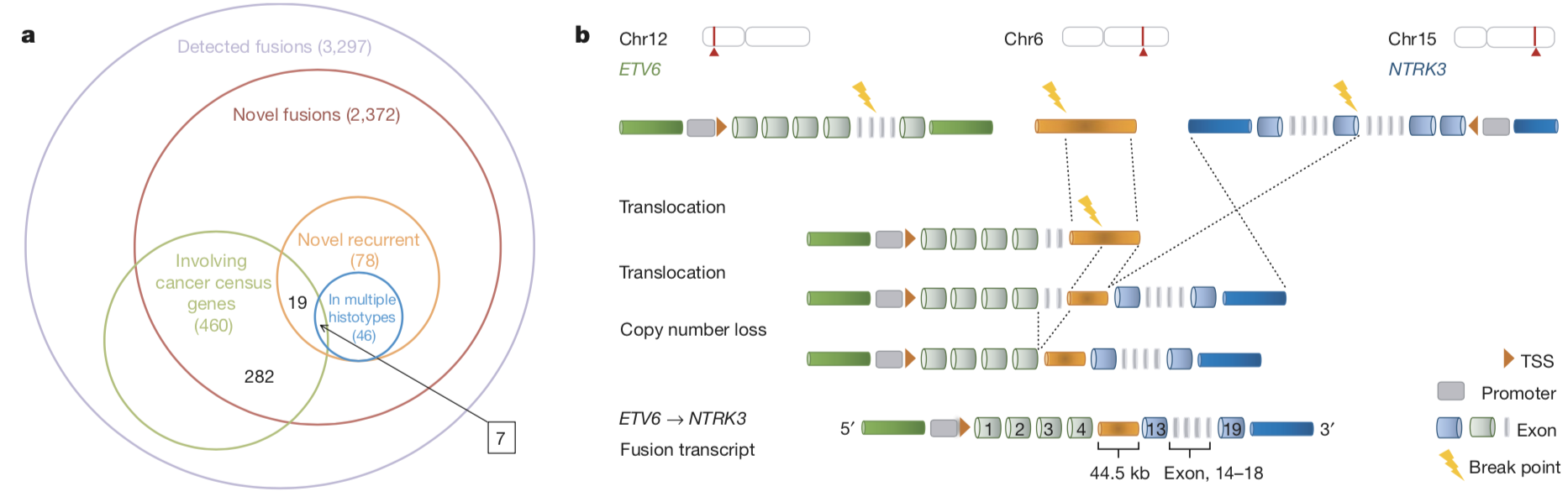
图2.与基因融合相关的结构变异
张泽民团队最后整合分析了多种类型的基因组、转录组变异,发现基因组变异和转录组变异的构成在不同癌种中具有高度异质性,且转录组变异在多条癌症通路和多个重要的癌症基因中具有很高的发生比例。他们通过共现(co-occurrence)分析探索了涉及已知癌症基因的基因组变异和转录组变异之间的反式关联,发现B2M基因可能与DNA修复改变或更高的突变耐受性有关。研究人员认为此类转录水平和基因水平变异的共现可以通过它们的功能联系来解释。
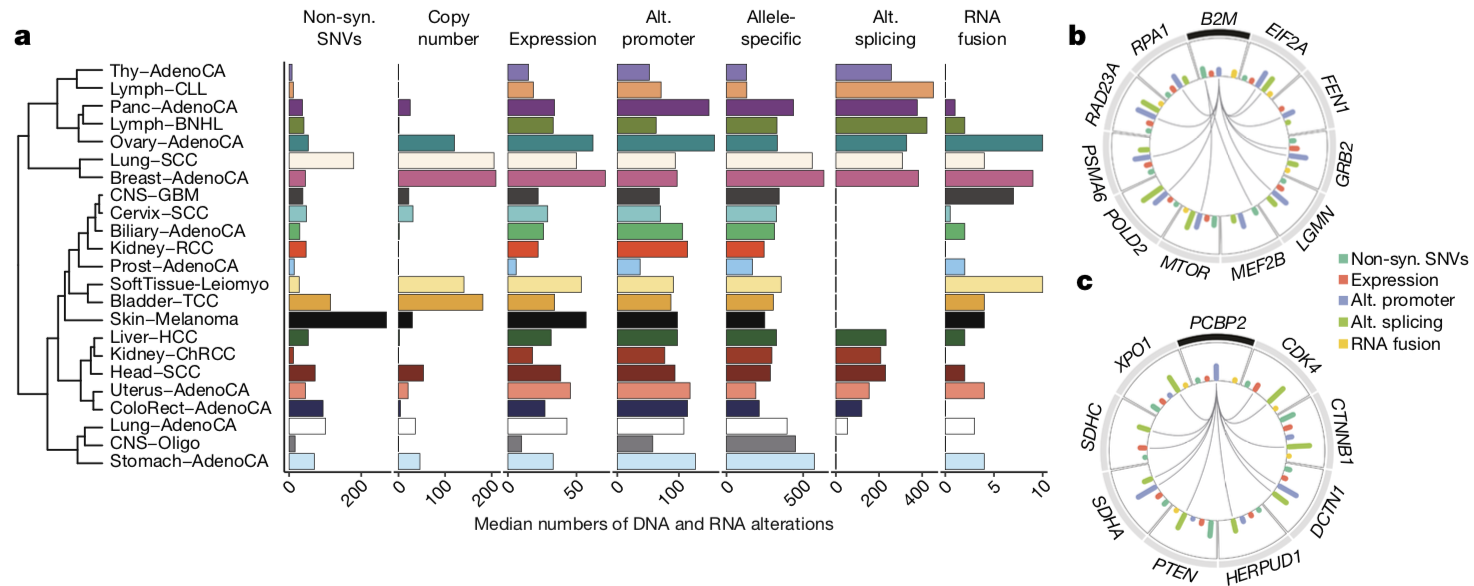
图3. 肿瘤DNA变异和RNA变异的全局图谱
该研究是迄今为止在癌症中最为全面的转录组变异研究。研究含括了27种不同的癌症,提供了泛癌症(pan-cancer)级别的统一的整合全基因组-转录组资源,展示了癌症中基因组层面和转录组层面的变异,为鉴定与癌症功能相关的基因和机制提供了丰富的资源。
北京大学前沿交叉学院的博士研究生何尧、北京大学生命科学学院的博士研究生刘凤麟等为论文的并列第一作者(按音序排列)。Alvis Brazma, Angela N. Brooks, Jonathan Göke, Gunnar Rätsch, Roland F. Schwarz, Oliver Stegle和张泽民教授共同指导该论文。北京大学前沿交叉学院的博士研究生张帆对论文亦有重要贡献。该研究由中国、美国、英国、瑞士、新加坡、日本、加拿大、德国、瑞典等多个国家共同参与,得到了国家自然科学基金、国家科技部以及北京未来基因诊断高精尖创新中心(ICG)的支持。