
Cell | 张泽民课题组与合作者揭示肝癌免疫微环境的动态特征
2019年10月31日,北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)张泽民课题组联合首都医科大学附属北京世纪坛医院彭吉润课题组以及德国药企勃林格殷格翰公司多位科学家,在国际期刊 Cell 上发表了题为Landscape and Dynamics of Single Immune Cells in Hepatocellular Carcinoma的研究论文,结合10x Genomics和SMART-seq2两种单细胞RNA测序技术,对肝癌患者多个组织的免疫细胞做了系统性的刻画,分析了免疫细胞动态迁移和状态转化的特征,探索了它们在肝癌治疗上的潜在价值。
研究思路
肝细胞癌是世界范围内死亡率排名第三的癌症,其中中国的肝癌发病率居世界之首[1]。HBV的慢性感染是中国肝细胞癌发生的主要原因,其感染导致肿瘤微环境常伴随慢性炎症。免疫逃逸被认为是癌症发展的标志之一,目前研究表明,肿瘤存在多种免疫逃逸机制,突出了研究肿瘤微环境中不同免疫细胞状态的重要性[2]。而单细胞测序技术则是研究不同类型免疫细胞的状态和动态的有力手段。
目前单细胞测序技术已经成为探究细胞类群多样性的常用技术手段,而不同的测序技术在细胞捕获和基因捕获效率上具有各自不同的优势[3]。例如,目前常用的10x Genomics测序技术基于微滴包被的原理,可实现一次实验获得较多的细胞数量,有效降低了单细胞测序的实验成本;而SMART-seq2测序技术则利用孔板对单个细胞进行实验,通量相对较低,但每个细胞的基因捕获率相对较高。因此,本研究结合了SMART-seq2和10x Genomics Chromium 3’两种单细胞测序技术,并整合这两种平台的数据进行生物信息学分析,充分发挥不同数据类型的优势,获得高分辨率的肝癌免疫图谱。
癌旁组织和外周血是肿瘤相关研究中常用的对照组织,而其他相关的免疫器官或病理组织则较少受到关注。例如,腹水是肝癌患者常见的病理现象,其产生与肝癌预后不良有关,然而腹水中的免疫细胞组成及其与肝癌的联系尚不清楚。因此,本研究收集肝癌病人的癌组织、癌旁组织、淋巴结、外周血和腹水五种组织的CD45+免疫细胞进行实验,并分析肝癌免疫微环境中的细胞类型、表达特征,以及不同组织之间细胞的动态变化与联系。
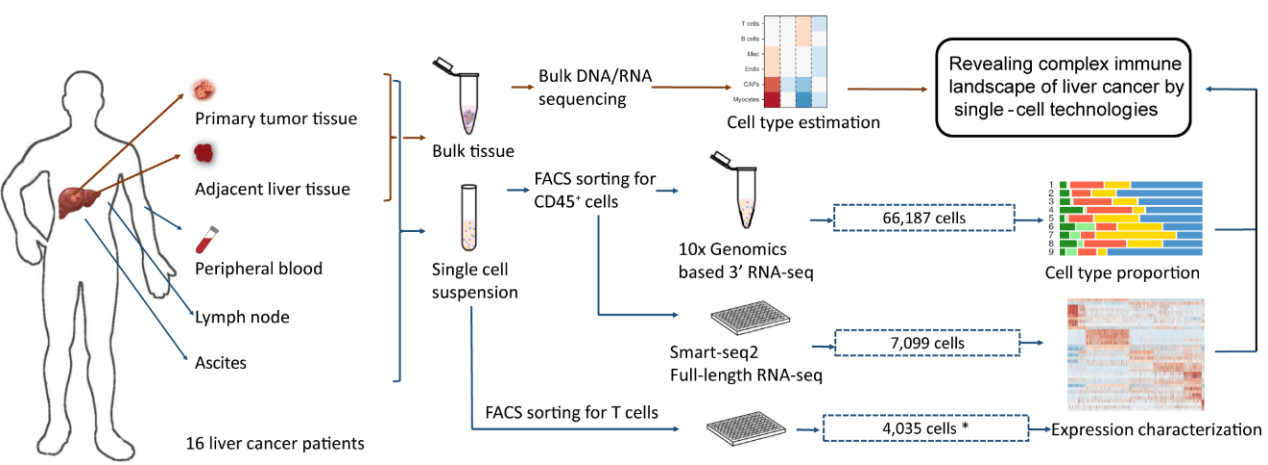
图1 课题总体设计
主要发现
1. 不同组织的免疫组成有较大差异,肿瘤中的巨噬细胞构成腹水中髓系细胞的主要来源
整合两种单细胞测序数据,研究人员刻画了高分辨率的肝癌免疫图谱,包括T细胞、B细胞、NK细胞和髓系细胞等主要细胞类群以及主要类群下属的40类细胞亚群。这些细胞亚群在不同组织中呈现出不同的细胞类型富集特征,其中腹水中的细胞类型呈现明显的特异性。
为探究腹水中细胞的潜在起源,研究者将腹水中的免疫细胞与其他组织中的细胞进行基因表达比对,发现腹水中的淋巴细胞和髓系细胞来源明显不同,淋巴细胞与外周血来源的细胞有明显的相似性,而髓系细胞主要和肿瘤组织来源的细胞类似。随后,通过前沿的生物信息学分析方法RNA velocity[4]和基于线粒体突变的进化树构建[5],研究者对巨噬细胞从肿瘤到腹水的迁移过程进行了确认。
2. 肿瘤中的巨噬细胞呈现两种不同的状态(TAM-like和MDSC-like)
通过与其他数据中的巨噬细胞进行转录组比对,研究者发现肝癌肿瘤中的巨噬细胞呈现两种不同的状态:TAM-like和MDSC-like状态。生存分析表明,前者的特征基因,特别是 SLC40A1 和 GPNMB 与不良预后有关。通过CRISPR技术在THP-1诱导的巨噬细胞系中进行基因敲除和功能验证实验,研究者发现这两个基因在细胞炎症反应中起重要作用。
3. 肿瘤中的 LAMP3 + DC是成熟态的DC,具有向肝淋巴结迁移和与多种淋巴细胞相互作用的潜在能力
肿瘤微环境中的树突状细胞(DCs),传统上分为cDC1和cDC2,而本研究鉴定出一群特点突出的 LAMP3 + DC。这群DC与cDC1和cDC2在表达特征上有较大的差别,主要表达 CD80 , CD83 , CCR7 等与成熟和细胞迁移有关的基因。而且这一类树突状细胞不仅存在于肝癌中,也存在于乳腺癌[6]和肺癌[7]中。随后,研究者通过体外实验证实了 LAMP3 + DC是成熟态的DC,且具有较高的迁移能力。通过前沿的生物信息学分析方法RNA velocity[4]和基于线粒体突变的进化树构建[5],研究者发现 LAMP3 + DC可能同时起源于cDC1和cDC2,且具有向肝淋巴结迁移的潜在能力。
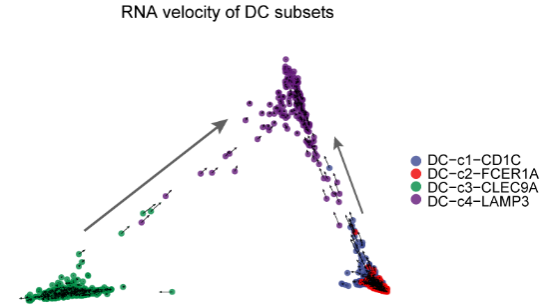
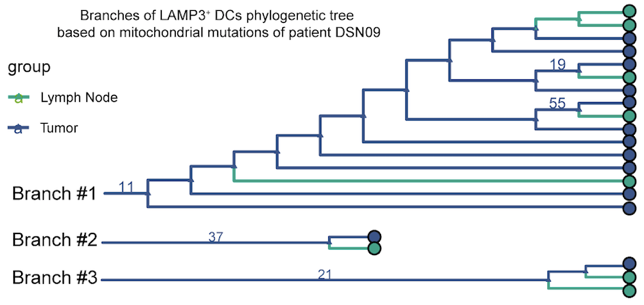
图2 左图:将肝癌组织中树突状细胞的RNA velocity的计算结果投射到在Diffusion Map坐标上,颜色代表不同的细胞群。右图:基于线粒体基因突变构建的 LAMP3 + DC进化树
肿瘤浸润的 LAMP3 + DC发挥了广泛调节淋巴细胞的作用,它们与T细胞和NK细胞上表达的配体-受体相互作用数量最多。 LAMP3 + DC通过CCL19-CCR7和CCL22-CCR4吸引T细胞,并通过CD86-CD28作用于调节T细胞亚群,通过CD86-CTLA4作用于耗竭性T细胞亚群。研究者通过多色免疫组化对表达PD-1的T细胞与表达PD-L1的LAMP3+ DC进行了空间位置的判断,发现其出现在相邻的位置,为其相互作用提供了蛋白水平的证据。然而, LAMP3 + DC在肿瘤中的作用与功能仍需要进一步的研究和验证。
讨论
文章的共同通讯作者任仙文副研究员特别指出,本项研究首次对肝癌临床样本进行包括病理组织在内的多组织位点的收集,并利用前沿的生物信息学分析方法,通过自体对照,不仅描述了肝癌微环境的免疫组分和状态,而且描绘了肿瘤浸润免疫细胞跨组织的动态过程。此项国际领先的开创性工作,可为人们研究肝癌和其他疾病中的免疫细胞,以及开发新的临床检测与治疗方案提供新的思路。例如,研究揭示了肿瘤中的巨噬细胞构成腹水中髓系细胞的主要来源。由于外周血的免疫特征与肿瘤中具有较大差异,而组织活检的取样难度相对较大,该结果为利用肝癌病人的腹水代替外周血或活检组织进行肿瘤免疫状态检测提供了新的思路。针对巨噬细胞中与较差预后相关的基因 GPNMB 和 SLC40A1 ,研究者通过揭示其在巨噬细胞中的炎症作用,为相关药物开发提供了潜在靶点。而研究发现的 LAMP3 +树突状细胞,可从肿瘤迁移到外周淋巴结,表达多种免疫配体基因,并具有与多种T淋巴细胞类型相互作用的潜力。这为后续进一步对该细胞类型进行研究和应用提供了基础,为通过调节免疫微环境进行肿瘤治疗提出了新的可能性,并为基于树突状细胞的细胞疗法提供了新的思路和依据。
为方便研究人员对相关领域进行深入探究,本研究中的肝癌单细胞数据已上传至交互式网站,可通过http://cancer-pku.cn:3838/HCC/进行查看。北京大学BIOPIC和生命科学学院博士生张启明、北京大学前沿交叉学院博士生何尧和北京大学第九临床医学院(北京世纪坛医院)博士生罗楠为该论文的并列第一作者,北京大学BIOPIC和生命科学学院任仙文副研究员、张泽民教授、勃林格殷格翰公司主任科学家刘康博士和北京世纪坛医院彭吉润教授为该论文的共同通讯作者。该课题得到了自然科学基金和北京未来基因诊断高精尖创新中心的资助,以及北大高通量测序平台的协助与支持。
____________________________
张泽民教授简介

张泽民,北京大学生物医学前沿创新中心(BIOPIC)与北京未来基因诊断高精尖创新中心(ICG)研究员,北京大学生命科学学院讲席教授,北大清华联合中心高级研究员。1988年本科毕业于南开大学,经CUSBEA赴美留学, 于1995年在宾州州立大学获得生物化学和分子生物学博士学位。在旧金山加州大学进行博士后研究工作后,于1998年任职于美国Genentech公司,开始生物信息和癌症基因组研究工作,曾任系主任、生物信息首席科学家。2014年加入北京大学,致力于生物信息、癌症基因组和肿瘤免疫研究。他的实验室目前正利用前沿的实验技术和生物信息学方法进行肿瘤及其微环境的异质性、耐药性、以及免疫细胞和肿瘤细胞的相互作用等方面的研究。2018年作为创始人建立百奥智汇科技有限公司,致力于挖掘单细胞基因组学和生物信息学在人类疾病诊断和治疗上的应用。张泽民教授已多次在 Cell 、 Nature 、 Nature Genetics 、 Nature Biotechnology 、 Nature Medicine 等国际著名杂志上发表论文,并担任多家专业杂志的编委,包括“ Cell Systems ”, “ Genome Medicine ”和“ Cell Reports ”。
任仙文副研究员简介

任仙文,北京大学副研究员。2010年毕业于中国科学院数学与系统科学研究院,获得运筹学与控制论博士学位。随后任职于中国医学科学院病原生物学研究所,任助理研究员、副研究员,从事宏基因组测序数据的生物信息分析工作,参与完成了中国蝙蝠类、啮齿类动物携带病毒谱的扫描工作,发现了数百种新病毒,包括新SARS-like冠状病毒、MERS-like冠状病毒、Henipa-like病毒,相关研究被Science杂志特别评论,相关技术获得专利授权1项并在临床中得到了应用,于2014年获颁“协和新星”荣誉称号,于2016年获得教育部科技进步一等奖,排名第三。2016年加入北京大学,致力于单细胞转录组测序的生物信息学分析和肿瘤免疫的研究,针对大规模单细胞测序数据的聚类问题、单细胞组织分布的定量问题、发育路径和跨组织迁移等动态行为的推测问题等重要前沿生物信息学问题提出了关键技术创新。在 Cell 、 Nature 、 Nature Medicine 、 Genome Biology 、 Nucleic Acids Research 、 Bioinformatics 等国际知名杂志上发表论文40多篇,其中第一作者或通讯作者论文30篇,并担任Frontiers in Genetics等杂志编辑。
参考文献>>
1. Forner A., Reig M. and Bruix J., Hepatocellular carcinoma, Lancet 391, 2018, 1301–1314.
2. Gnjatic S., Bronte V., Brunet L.R., Butler M.O., Disis M.L., Galon J., Hakansson L.G., Hanks B.A., Karanikas V., Khleif S.N., et al., Identifying baseline immune-related biomarkers to predict clinical outcome of immunotherapy, J. Immunother. Cancer 5, 2017, 44.
3. Ziegenhain C., Vieth B., Parekh S., Reinius B., Guillaumet-Adkins A., Smets M., Leonhardt H., Heyn H., Hellmann I. and Enard W., Comparative Analysis of Single-Cell RNA Sequencing Methods, Mol. Cell 65, 2017, 631–643.e4.
4. La Manno G., Soldatov R., Zeisel A., Braun E., Hochgerner H., Petukhov V., Lidschreiber K., Kastriti M.E., Lönnerberg P., Furlan A., et al., RNA velocity of single cells, Nature 560, 2018, 494–498.
5. Ludwig L.S., Lareau C.A., Ulirsch J.C., Christian E., Muus C., Li L.H., Pelka K., Ge W., Oren Y., Brack A., et al., Lineage Tracing in Humans Enabled by Mitochondrial Mutations and Single-Cell Genomics, Cell 176, 2019, 1325–1339.e22.
6. Michea P., Noël F., Zakine E., Czerwinska U., Sirven P., Abouzid O., Goudot C., Scholer-Dahirel A., Vincent-Salomon A., Reyal F., et al., Adjustment of dendritic cells to the breast-cancer microenvironment is subset specific, Nat. Immunol. 19, 2018, 885–897.
7. Zilionis R., Engblom C., Pfirschke C., Savova V., Zemmour D., Saatcioglu H.D., Krishnan I., Maroni G., Meyerovitz C.V., Kerwin C.M., et al., Single-Cell Transcriptomics of Human and Mouse Lung Cancers Reveals Conserved Myeloid Populations across Individuals and Species, Immunity 50, 2019, 1317–1334.e10.